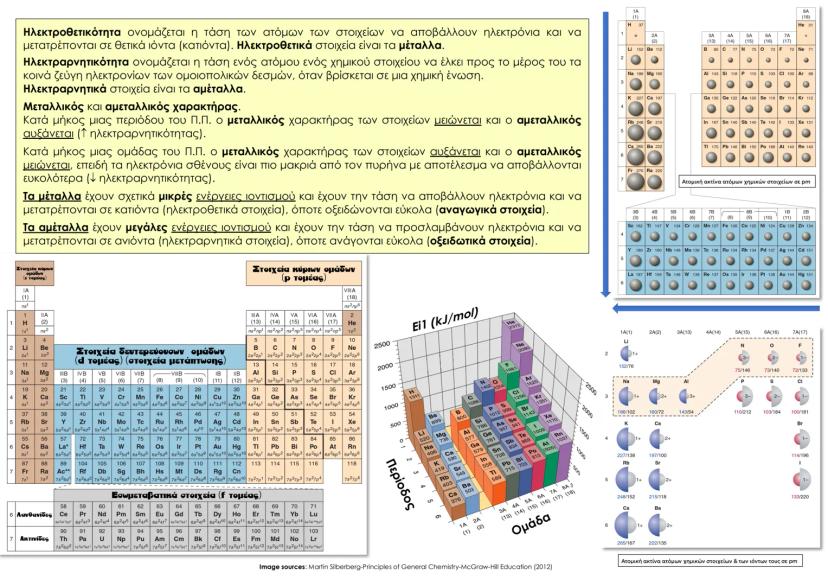
Κβαντικοί Αριθμοί
Τώρα έρχεται το συναρπαστικό κομμάτι! Τρεις αριθμοί καθορίζουν πλήρως έναν χώρο στο άτομο - είναι σαν την "διεύθυνση" του ηλεκτρονίου!
Κύριος κβαντικός αριθμός (n): Καθορίζει το μέγεθος του ηλεκτρονιακού νέφους και την ενέργεια. n = 1, 2, 3...
Δευτερεύων κβαντικός αριθμός (l): Καθορίζει το σχήμα του νέφους. l = 0, 1, 2... n−1
Μαγνητικός κβαντικός αριθμός (mₗ): Καθορίζει τον προσανατολισμό στον χώρο. mₗ = -l, -l+1... 0... +l-1, +l
Στιβάδες και υποστιβάδες:
- Στιβάδα Κ, L, M... (ίδιος n)
- Υποστιβάδα s, p, d, f... (ίδιοι n και l)
Μυστικό επιτυχίας: Κάθε τριάδα (n, l, mₗ) δίνει ένα μοναδικό ατομικό τροχιακό!