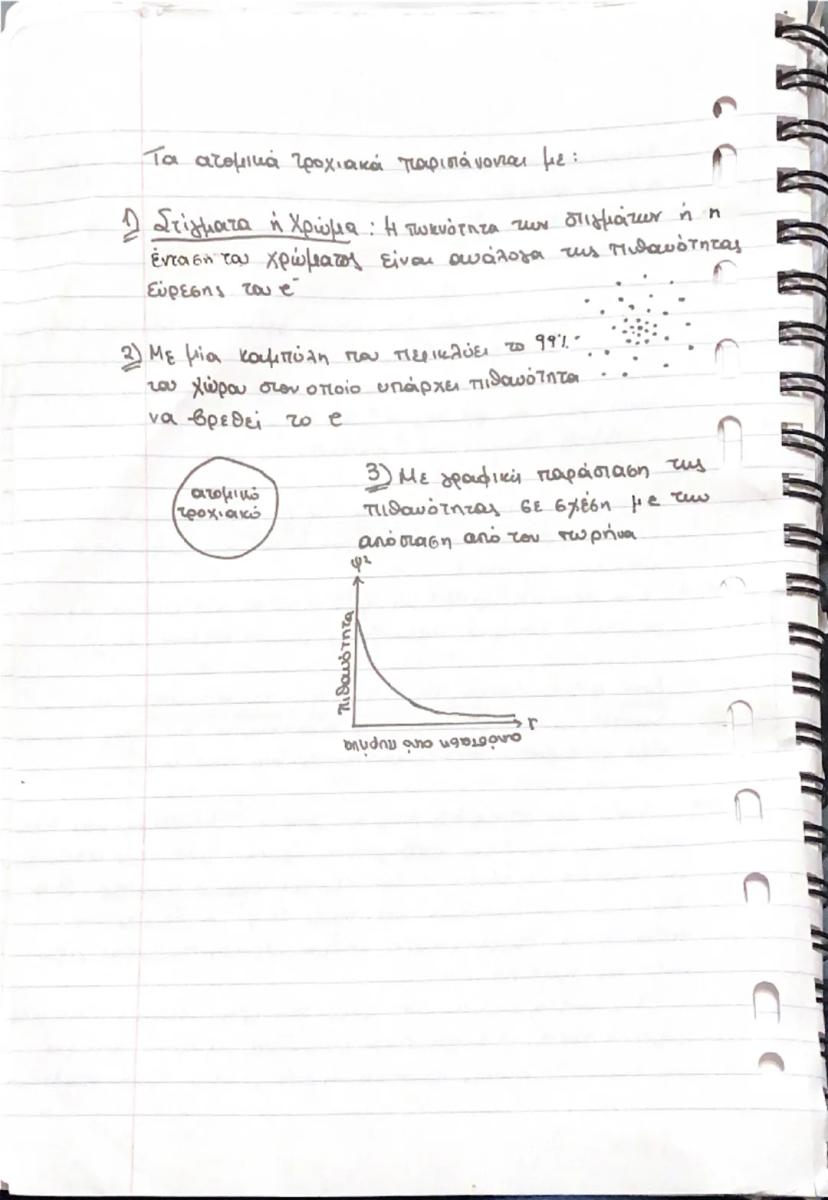
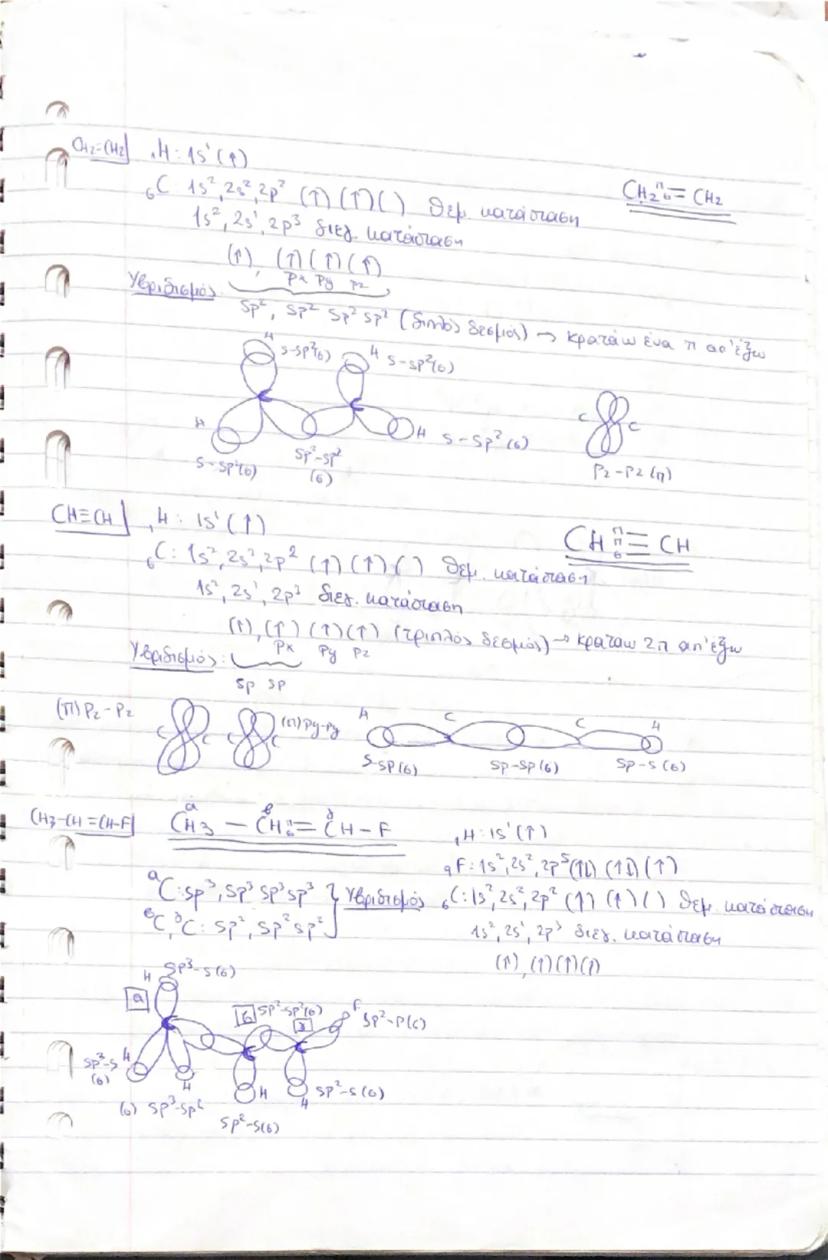
Κβαντικοί Αριθμοί - Η "Διεύθυνση" κάθε Ηλεκτρονίου
Κάθε ηλεκτρόνιο στο άτομο έχει μια μοναδική "διεύθυνση" που καθορίζεται από τέσσερις κβαντικούς αριθμούς. Είναι σαν το ταχυδρομικό κώδικα που καθορίζει ακριβώς πού βρίσκεται!
Ο κύριος κβαντικός αριθμός n (1,2,3...) δείχνει την απόσταση από τον πυρήνα και καθορίζει τη στιβάδα (K, L, M, N...). Όσο μεγαλύτερο το n, τόσο μεγαλύτερη η ενέργεια.
Ο αζιμουθιακός αριθμός l 0,1,2...n−1 καθορίζει το σχήμα του τροχιακού: l=0→s (σφαιρικό), l=1→p (αλτήρας), l=2→d (πολύπλοκα σχήματα), l=3→f (ακόμα πιο πολύπλοκα). Το ζεύγος (n,l) καθορίζει την υποστιβάδα.
Ο μαγνητικός αριθμός ml −l...+l δείχνει τον προσανατολισμό του τροχιακού. Ο spin ms (±½) δείχνει την "αυτοπεριστροφή" του ηλεκτρονίου.
💡 Θυμήσου: Η τετράδα (n,l,ml,ms) είναι μοναδική για κάθε ηλεκτρόνιο - δεν μπορούν δύο ηλεκτρόνια να έχουν την ίδια!