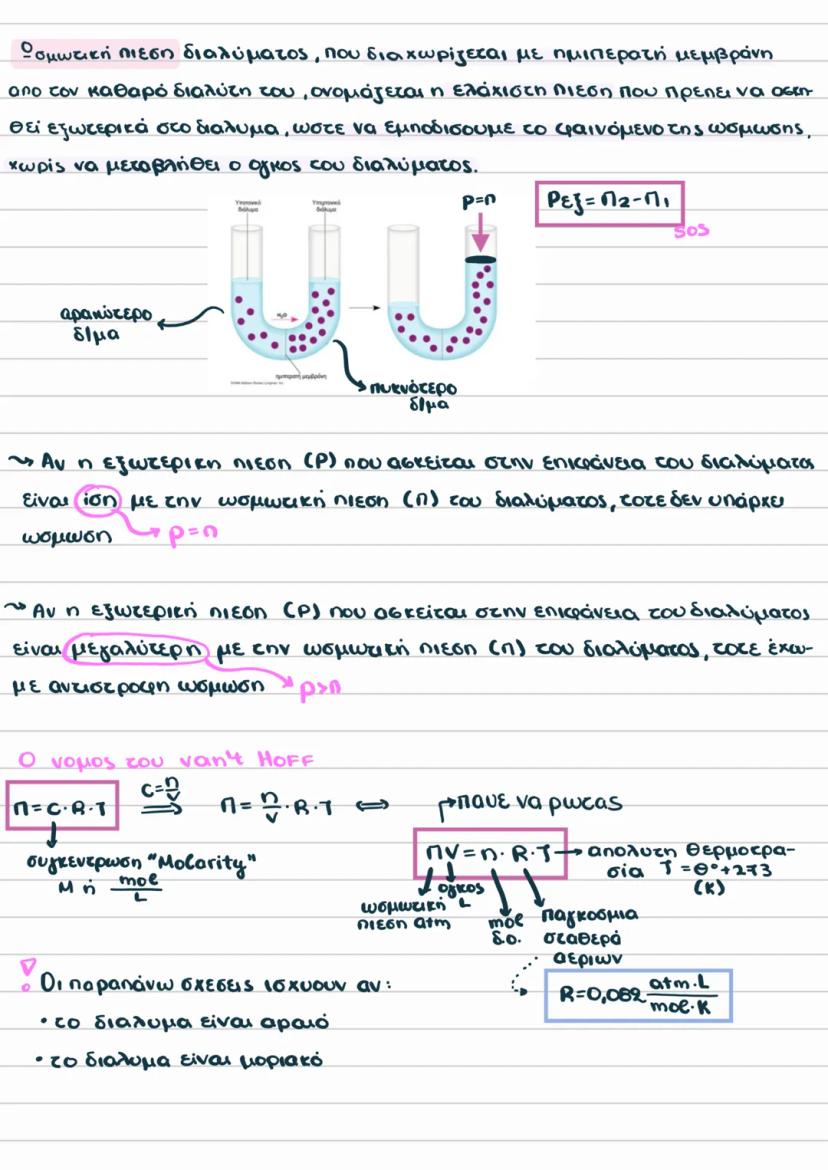
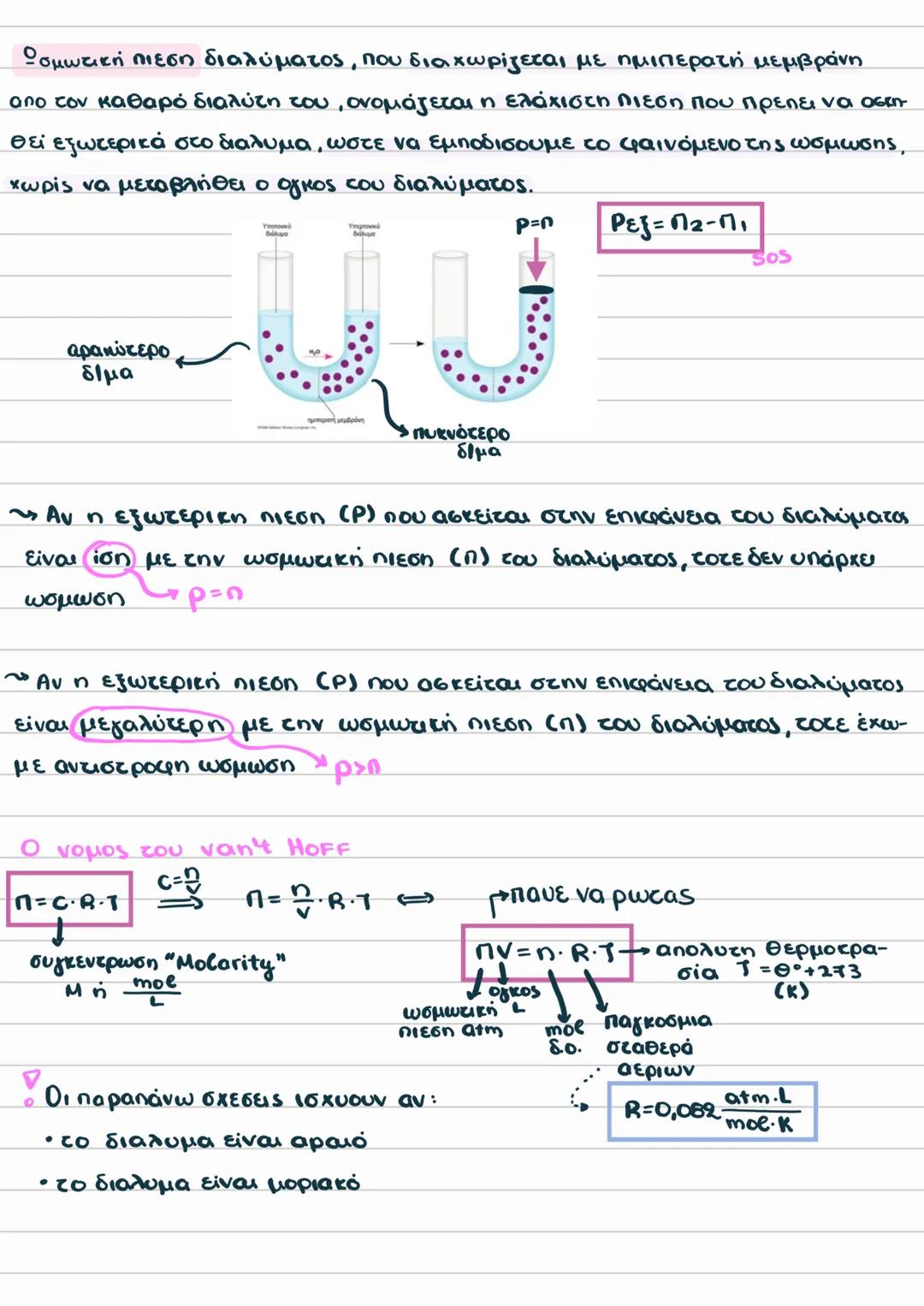
Παρατηρήσεις και Ωσμωμετρία
Η ωσμωτική πίεση έχει δύο μοναδικά χαρακτηριστικά που την κάνουν ξεχωριστή. Πρώτον, είναι η μόνη προσθετική ιδιότητα που εξαρτάται από τη θερμοκρασία - όσο πιο ζεστό, τόσο μεγαλύτερη ωσμωτική πίεση!
Δεύτερον, όταν έχεις περισσότερες από μία διαλυμένες ουσίες, η συνολική ωσμωτική πίεση είναι το άθροισμα όλων: Π = C_ολ · R · T. Αυτό σημαίνει ότι κάθε ουσία "συνεισφέρει" στην τελική πίεση.
Η ωσμωμετρία είναι η έξυπνη μέθοδος για να βρεις τη σχετική μοριακή μάζα μιας άγνωστης ουσίας. Χρησιμοποιώντας τον τύπο Mr = (m·R·T)/(Π·V), μπορείς να "ταυτοποιήσεις" την ουσία!
Τα διαλύματα χωρίζονται σε τρεις κατηγορίες: ισοτονικά (ίδια ωσμωτική πίεση), υποτονικά (μικρότερη) και υπερτονικά (μεγαλύτερη).
Χρήσιμο: Η ωσμωμετρία είναι πολύ ακριβής μέθοδος για τον προσδιορισμό μοριακής μάζας!